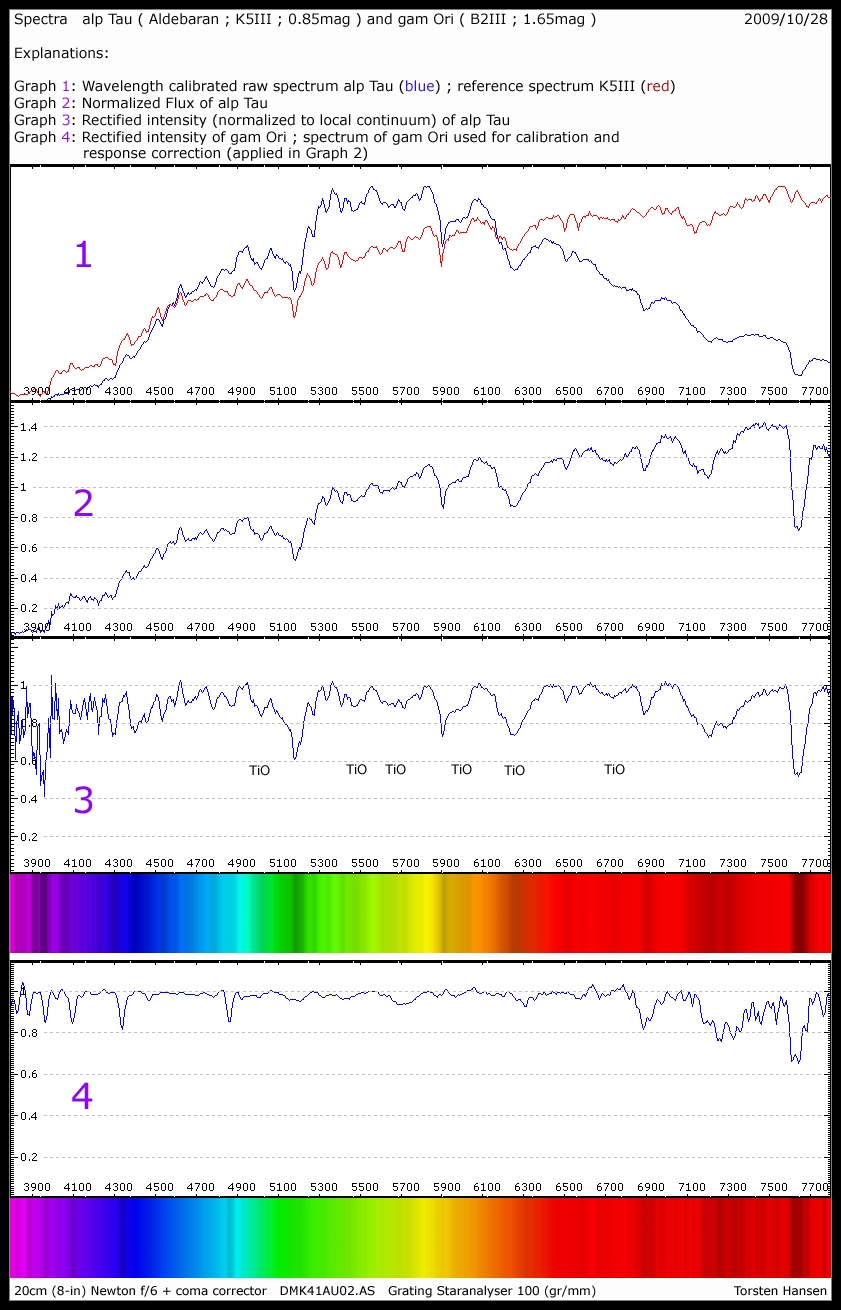
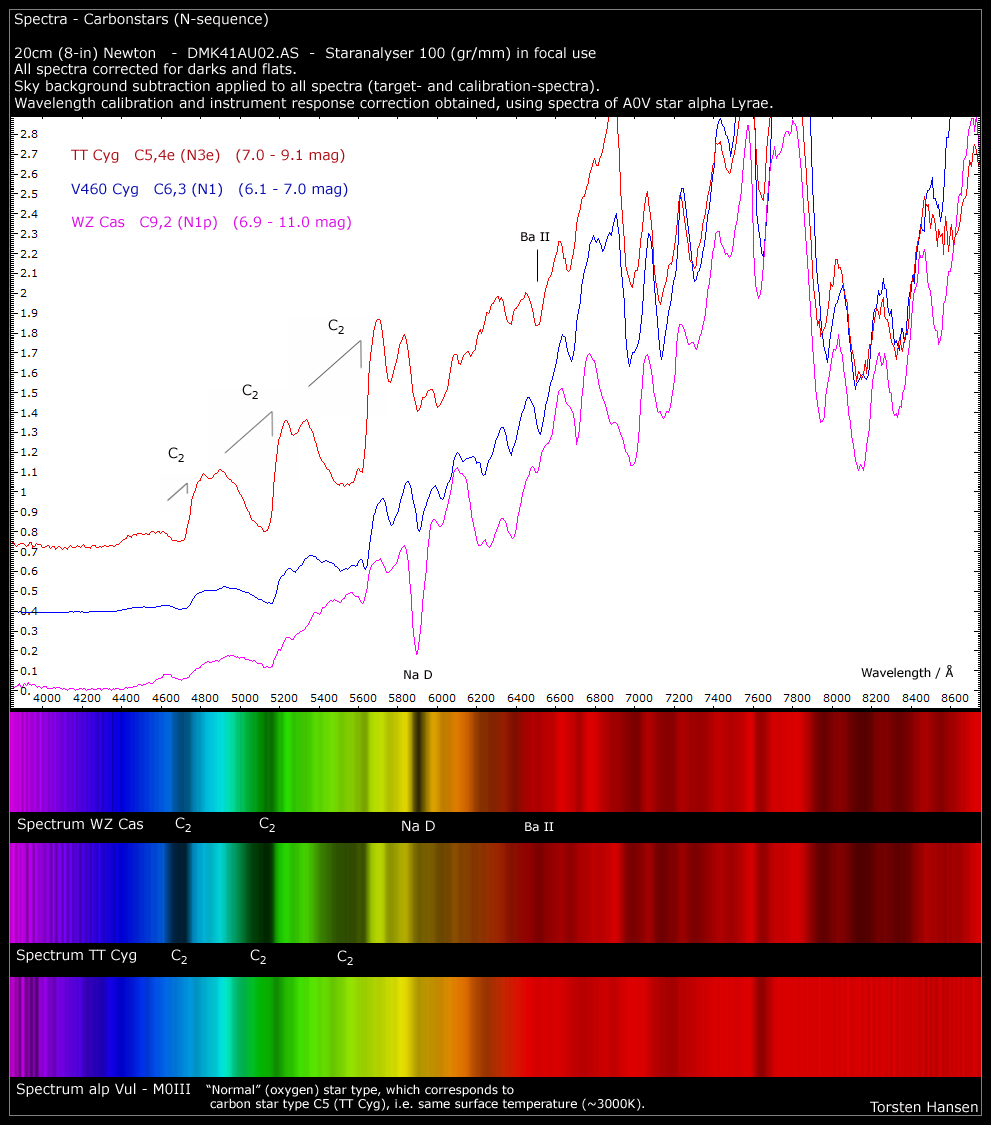
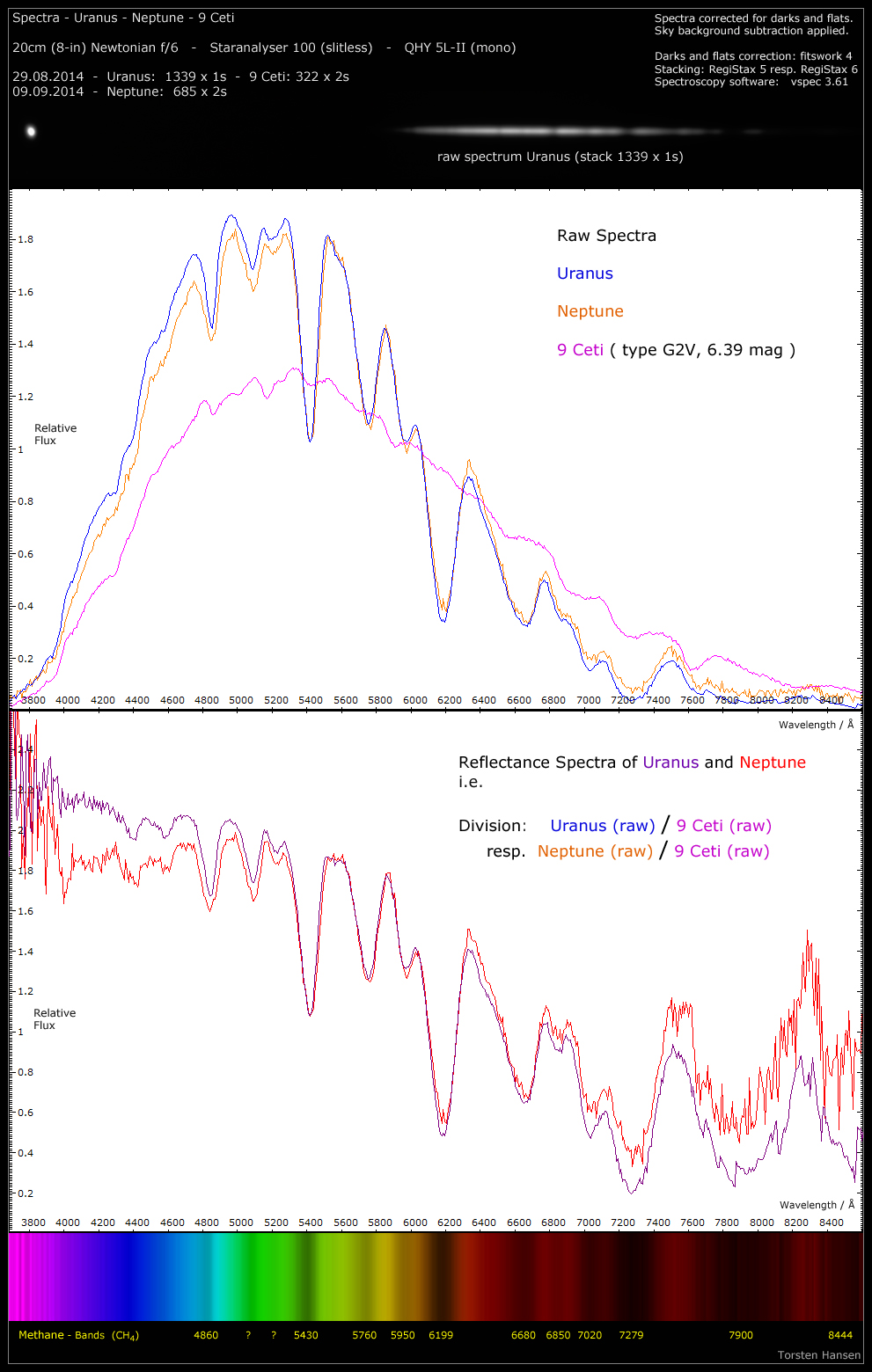
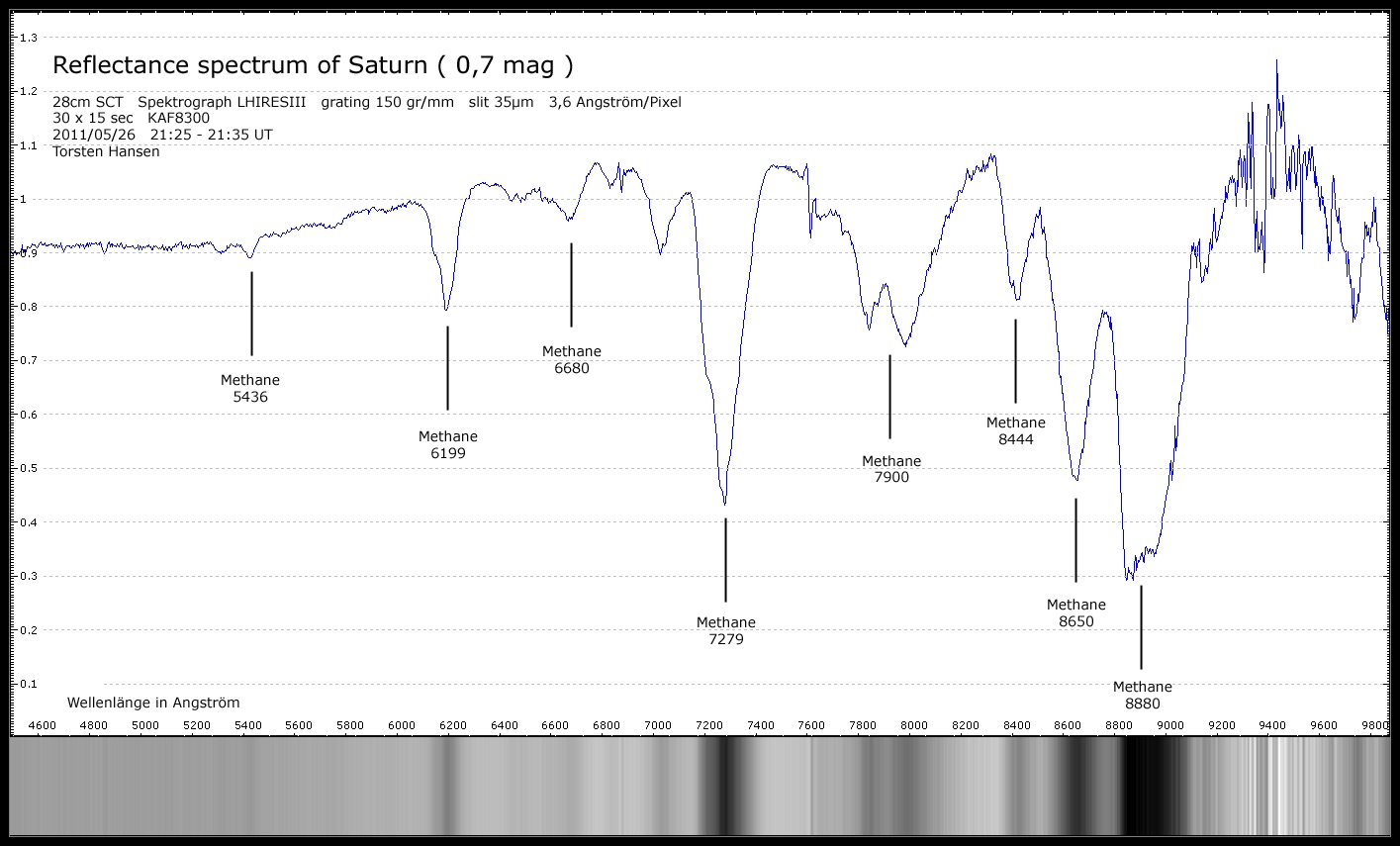
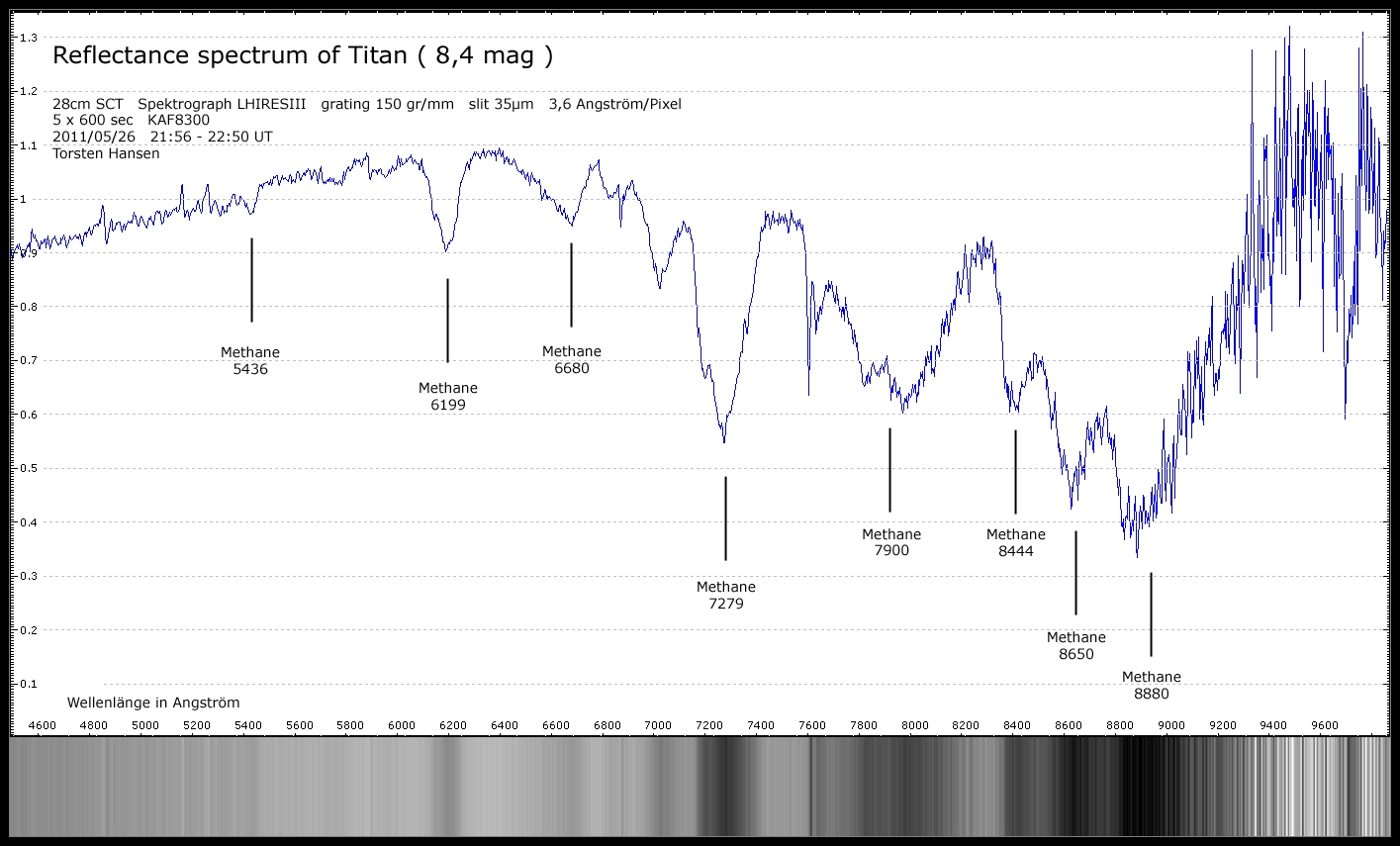
Hallo,
Beim stöbern in der Wikipedia fand ich die Information das z.b Methylamin
auch im Weltraum vorkommt. Da stellte sich bei mir die Frage wie man mit der
Spektroskopie, chemische Verbindungen im Spektrum nachweisen kann?
Ich fand einen Artikel über, das Bandenspektrum und das überlappende Spektrallinien auf chemische Verbindung hinweisen.
Liege ich da richtig und kann man chemische Verbindungen im Spektrum mit Mitteln der Amateurastronomie nachweisen?
Ich weiß zum Beispiel dass man das Spektrum eines Sterns mit einer Digitalkamera beziehungsweise Astro–Cam aufnehmen kann und mittels Software
auswerten kann.
Grüße
Sven.